Co to jest homocysteina?
Homocysteina (Hcy) jest rodzajem aminokwasu siarkowego, którego metabolizm podlega szeregowi skomplikowanych procesów biochemicznych (Rycina 1). Potocznie homocysteinę nazywa się również cholesterolem XXI wieku z uwagi na związek homocyteiny z patomechanizmem chorób sercowo-naczyniowych. Homocyteina powstaje z innego aminokwasu – metioniny w procesie nazywanym demetylacją. Sam proces demetylacji polega na usunięciu z metioniny grupy metylowej w wyniku reakcji enzymatycznej. Pomimo że homocysteina jest aminokwasem, to nie jest wbudowywana w struktury białkowe w komórce i pełni funkcję produktu pośredniego w szlakach biochemicznych. Nadmiar homocysteiny jest przekształcany w nietoksyczną cysteinę przy udziale enzymu syntazy cystationinowej (CBS, ang. cystathionine-beta-synthase). Uproszczony schemat jej metabolizmu w organizmie został przedstawiony na poniższej rycinie:
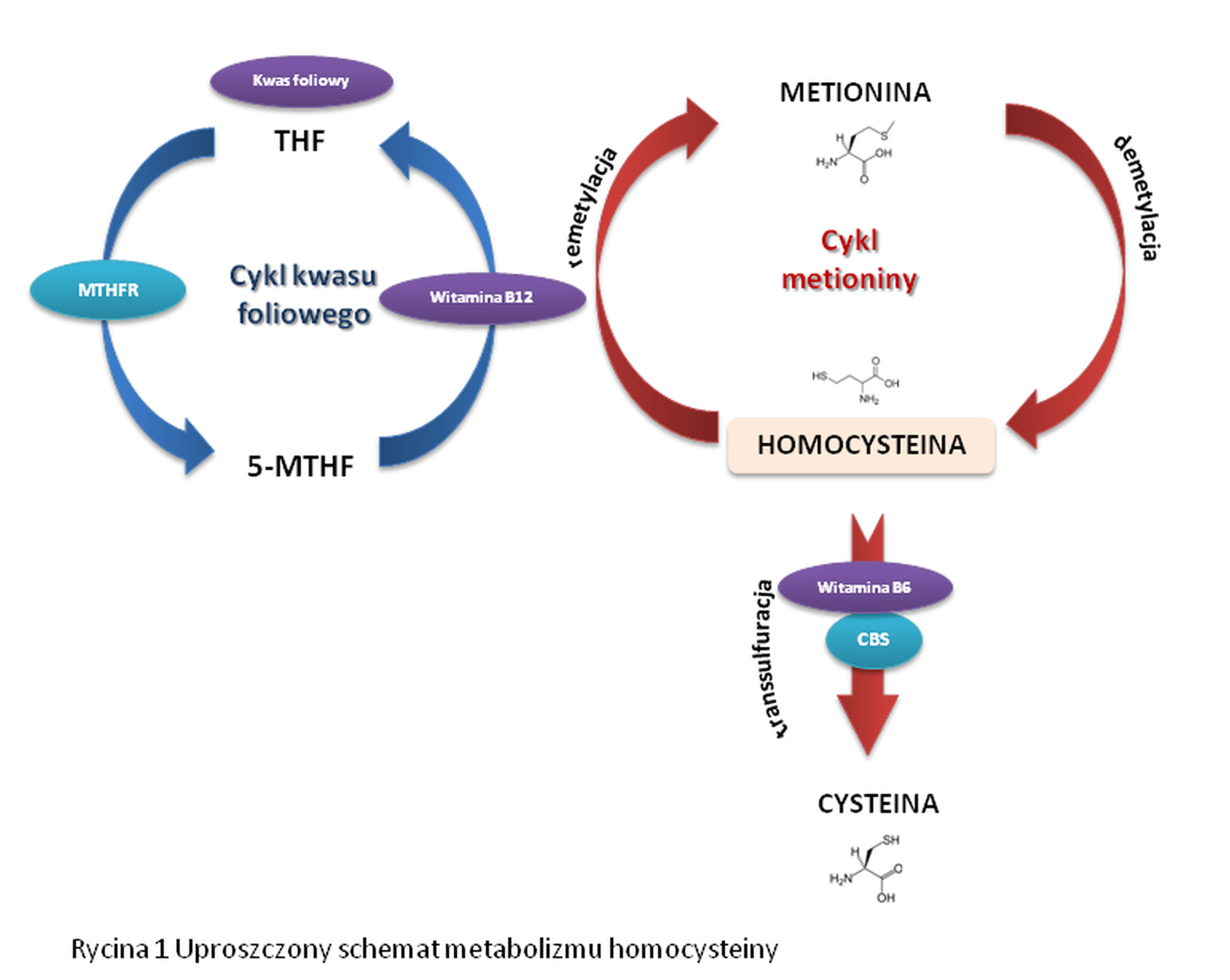
Biocząsteczkami, które w istotny sposób modulują metabolizm homocysteiny, są kwas foliowy (inaczej witamina B9), witamina B6 i witamina B12. Ich niedobór jest związany ze zmniejszonym metabolizmem homocysteiny oraz jej wzrostem we krwi. Taki stan kliniczny nazywamy hiperhomocysteinemią.
Homocysteina jest toksyczna i dlatego jej nadmiar musi być sprawnie usuwany z organizmu wraz z moczem, głównie za pośrednictwem nerek. W ostatnim czasie homocysteina wzbudza duże zainteresowanie naukowców i klinicystów z uwagi na jej prawdopodobny udział w rozwoju wielu przewlekłych chorób.
Homocysteina – przyczyny wzrostu jej stężenia we krwi
Do najczęstszych przyczyn wzrostu homocysteiny należą:
– niedobory kwasu foliowego, witaminy B6 oraz witaminy B12,
– mutacje genetyczne, w tym genów CBS i MTHFR,
– niski poziom hormonów tarczycowych,
– niewydolność nerek,
– nowotwory,
– choroby przewlekłe, np. otyłość, nadciśnienie tętnicze, cukrzyca,
– nieprawidłowa dieta,
– używki, np. palenie papierosów,
– niektóre leki, np. metotreksat, karbamazepina, tlenek diazotu, fenytoina, atorwastatyna, fenofibrat, tlenek azotu, kwas nikotynowy.
Dlaczego witaminy z grupy B są tak istotne w regulacji stężenia homocysteiny we krwi?
Większość witamin pełni w organizmie funkcje tzw. kofaktorów, czyli czynników wspomagających pracę enzymów, bez których nie mogą zachodzić kluczowe procesy biologicznie. Niedobór powyższych witamin (Rycina 1) uniemożliwia prawidłowe zachodzenie przemian toksycznej homocysteiny w nietoksyczną cysteinę i metioninę.
Wpływ mutacji genetycznych na poziom homocysteiny
Mutacje genetyczne w genach kodujących enzymy biorą udział w szklaku przemian homocysteiny oraz wpływają na jej stężenie we krwi. Wspomniany wcześniej enzym CBS jest kodowany przez gen CBS, którego mutacje powodują rzadką genetyczną chorobę – homocystynurię. Mutacje genu CBS powodują blok metaboliczny i uniemożliwiają przekształcania homocysteiny w cysteinę. Jednym z objawów jest pojawienie się homocysteiny w moczu.
Innym enzymem, który odgrywa kluczową rolę w metabolizmie homocysteiny, jest reduktaza metylenotetrahydrofolianu (MTHFR, ang. methylenetetrahydrofolate reductase). MTHFR przekształca kwas foliowy z pożywienia w jego postać czynną, która może być wykorzystana przez organizm na poziomie komórkowym. W ten sposób MTHFR pośrednio wpływa na przemianę toksycznej homocysteiny w metioninę z udziałem kwasu foliowego. Enzym jest kodowany przez gen o tej samej nazwie – MTHFR. Udowodniono, że niektóre mutacje genu MTHFR są odpowiedzialne za upośledzenie aktywności enzymatycznej MTHFR. Wynika to z faktu, że mutacja wpływa na sekwencję aminokwasów w strukturze enzymu, a co za tym idzie nieefektywne wykorzystanie kwasu foliowego. Zmniejsza się ilość 5-MTHF, który jest donorem grupy metylowej niezbędnej do remetylacji homocysteiny do metioniny (Rycina 1). U osób z niektórymi mutacjami genu zauważa się 20% aktywność enzymu MTHFR w porównaniu z osobami bez mutacji. W konsekwencji obserwuje się u nich obniżenie stężenia kwasu foliowego oraz podwyższone stężenie homocysteiny we krwi.
Opisano dwie najczęstsze mutacje genu MTHFR, które mają niekorzystny wpływ na stężenie homocysteiny we krwi:
– mutacja c.677C>T (Ala222Val) występuje u 8–20% mieszkańców Ameryki Północnej, Europy i Australii;
– mutacja c.1298A>C (Glu429Ala) występuje u 7–12% mieszkańców Ameryki Północnej, Europy i Australii.
Konsekwencje zaburzeń metabolizmu homocysteiny
Wysoki poziom homocysteiny może prowadzić do:
– zawału mięśnia sercowego,
– udaru niedokrwiennego mózgu,
– zakrzepicy żył,
– powikłań w ciąży, takich jak nadciśnienie tętnicze, odklejenie się łożyska, nawracające poronienia,
– wad cewy nerwowej u płodu,
– chorób neurodegeneracyjnych. Wykazano, że u osób z hiperhomocysteinemią ryzyko wystąpienia choroby Alzheimera jest kilkukrotnie wyższe w porównaniu z osobami z prawidłowymi jej wartościami.
Homocysteina a stężenie cholesterolu
Chorobotwórczość homocyteiny wynika z wielu mechanizmów. Jednym z najlepiej poznanych jest jej wpływ na procesy miażdżycowe w naczyniach krwionośnych. Związana z homocysteinemią miażdżyca jest niezależnym czynnikiem choroby niedokrwiennej serca.
Pierwszym etapem procesu miażdżycowego jest uszkodzenie nabłonka naczyń krwionośnych (śródbłonka). Następnie lipoproteiny o niskiej gęstości (LDL), czyli tzw. zły cholesterol, podlegają różnym modyfikacjom chemicznym, w tym procesom utleniania. Utleniony LDL (oxLDL) łatwiej odkłada się w naczyniach krwionośnych.
Homocysteina ma zdolność modyfikowania LDL. Tworząc kompleksy z LDL, wpływa na jego odkładanie się w ścianach naczyń, podobnie oxLDL. Kolejnym etapem procesu jest pochłanianie przez komórki żerne (makrofagi) zmodyfikowanych LDL, m.in. przez homocysteinę. Tak „przeładowane” zmodyfikowanymi LDL makrofagi zmieniają się w komórki piankowate, które odkładają się w naczyniach krwionośnych, tworząc blaszkę miażdżycową.
Wzrost homocysteiny również koreluje negatywnie z enzymem dysmutazą ponadtlenkową, która neutralizuje szkodliwe wolne rodniki odpowiedzialne za procesy utleniania. W wyniku tego powstaje jeszcze więcej oxLDL, które napędzają proces miażdżycowy. Sam proces miażdżycowy jest również źródłem zakrzepów. I tutaj homocysteina może nasilać ten proces poprzez wzmocnienie aktywności czynników krzepnięcia krwi.
Homocysteina a ciąża
Istotna rola kwasu foliowego dla kobiet w ciąży została po raz pierwszy podkreślona w latach 60. XX wieku. Następnie w latach 90. potwierdzono związek jego niedoboru z ryzykiem wad cewy nerwowej u płodu. Wiadomo, że wysoki poziom homocysteiny odzwierciedla nieprawidłowy metabolizm kwasu foliowego, dlatego naukowcy zainteresowali się związkiem homocysteiny i wadami cewy nerwowej. Wykazano, że u matek, które urodziły dzieci z wadami cewy nerwowej, w trakcie ciąży stwierdzono hiperhomocysteinemię, niezależnie od stężenia kwasu foliowego. Inne badania udowodniły związek pomiędzy wysokim stężeniem homocysteiny a nadciśnieniem tętniczym w ciąży, odklejaniem się łożyska oraz nawracającymi poronieniami.
Z kolei w badaniach na zwierzętach laboratoryjnych wykazano, że homocysteina w wysokich stężeniach wpływa negatywnie na rozwój mózgu, m.in. przez zwiększenie wrażliwości neuronów płodu na stres oksydacyjny. Jednak należy podkreślić, że w większości badań pomiarów stężenia homocyteiny dokonywano albo w ostatnim trymestrze ciąży, albo po porodzie. Dlatego rola homocysteiny w ciąży nie została do końca wyjaśniona.
Co ciekawe, samo stężenie homocysteiny w trakcie prawidłowego przechodzenia ciąży znacznie spada w porównaniu z poziomem stężenia u kobiet nieciężarnych, nawet o 30–60%. Udowodniono, że nie mają na to wpływu takie czynniki, jak suplementacja kwasem foliowym, co sugeruje, że obniżenie stężenia homocysteiny w ciąży może być rodzajem fizjologicznej adaptacji organizmu dotego stanu.
Obecność mutacji genu MTHFR zarówno u matki, jak i u dziecka może mieć związek z niektórymi powikłaniami ciążowymi. Jednak związek przyczynowo-skutkowy pozostaje wciąż niejasny.
Homocysteina – jak zbadać jej poziom?
Stężenie homocysteiny można zbadać za pomocą testów laboratoryjnych z krwi. Przed wykonaniem badania trzeba być na czczo. Istotne jest również, aby wziąć pod uwagę czynniki, które mogą fałszywie zawyżać poziom homocysteiny we krwi (patrz 2. Przyczyny wzrostu stężenia homocyteiny we krwi).
U niemowląt i dzieci z podejrzeniem wrodzonej hiperhomocysteinemii jako test przesiewowy wykonuje się badanie stężenia homocysteiny w moczu. Dostępna jest także diagnostyka genetyczna, która pozwala na stwierdzenie przyczyn wrodzonej hiperhomocysteinemii.
Czy hiperhomocysteinemię można leczyć?
Nie istnieje leczenie farmakologiczne, które mogłoby obniżyć stężenie homocysteiny we krwi. W postępowaniu poszukuje się przyczyny jej wzrostu i dąży się do jej wyeliminowania. Stwierdzono, że kluczem do obniżenia stężenia homocysteiny w osoczu krwi jest suplementacja kwasem foliowym, witaminą B6 i B12. Niektóre badania wskazują, że taka suplementacja może obniżyć stężenia homocysteiny we krwi, jednak nie wpływa to na zmniejszenie ryzyka wystąpienia chorób sercowo-naczyniowych i demencji.
Oczywiście najlepszym źródłem tych witamin jest odpowiednio zbilansowana dieta bogata w witaminy z grupy B. Do produktów bogatych w witaminy z grupy B zaliczamy jaja, zielone warzywa liściaste oraz owoce.
mgr Karolina Karabin
Biolog molekularny, diagnosta laboratoryjny
Bibliografia
Moll S., Varga E.A., Homocysteine and MTHFR Mutations, „Circulation” 2015, 132(1), e6–9.
McCaddon A. et. al., Total serum homocysteine in senile dementia of Alzheimer type, „International Journal of Geriatric Psychiatry” 1998, 13(4), 235–239.
Hibbard B.M., The role of folic acid in pregnancy with particular reference to anaemia, abruption and abortion, „The Journal of Obstetrics and Gynaecology of the British Commonwealth” 1964, 71, 529–542.
Steegers-Theunissen R.P. et. al., Neural-tube defects and derangement of homocysteine metabolism, „The New England Journal of Medicine” 1991, 324(3), 199–200.
Put N.M. et. al., Folate, homocysteine and neural tube defects. An overview, „Experimental Biology and Medicine” 2001, 226(4), 243–270.
Ray J.G., Laskin C.A., Folic acid and homocyst(e)ine metabolic defects and the risk of placental abruption, pre-eclampsia and spontaneous pregnancy loss. A systematic review, „Placenta” 1999, 20(7), 519–529.
Blaise S.A. et. al., Gestational vitamin B deficiency leads to homocysteine-associated brain apoptosis and alters neurobehavioral development in rats, „American Journal of Pathology” 2007, 170(2), 667–679.
Stephanie J.S. et. al., Homocystinuria Caused by Cystathionine Beta-Synthase Deficiency, Seattle 2017.
Krishnaswamy K., Lakshmi A.V., Role of nutritional supplementation in reducing the levels of homocysteine, „The Journal of the Association of Physicians of India” 2002, 50, 36–42.
Maron B.A., Loscalzo J., The Treatment of Hyperhomocysteinemia, „Annual Review of Medicine” 2009, 60, 39–54.





Komentarze
Farmakologicznie czyli tzw. lekami nie obnizymy homocysteiny ..potrzebna jest zdrowa dieta i pare miesiecy suplementacji mineralami i witaminami .Wiadomo juz ze same ....wybiorczo stosowane witaminy.. nie moga w niczym pomoc.Organizm to nie tylko serce czy watroba to wszystko z czego jestesmy zbudowani i patrzymy calosciowo .Zawsze mozna znalezsc cos dla swojego przypadku,,trzeba tylko chciec byc zdrowym .Wlaczyc myslenie ,mowi dr.Hubert Czerniak.